Panoramica generale dell'afta epizootica europea
Con la Direttiva sui medicinali falsificati (FMD) pubblicata nel luglio 2011, il Agenzia europea per i medicinali (EMA) impostare l'inizio degli standard di tracciabilità dei paesi dell'Unione Europea.
IL Direttiva sui medicinali falsificati (direttiva 2011/62/UE) introduce misure europee armonizzate per combattere la contraffazione dei medicinali e garantire che i medicinali siano sicuri e che i medicinali in circolazione siano rigorosamente controllati. Le misure includono:
- Caratteristiche di sicurezza obbligatorie – un identificatore univoco e un dispositivo antimanomissione – sull'imballaggio esterno dei medicinali
- Un logo comune in tutta l'UE per identificare le farmacie online legali
- Norme più severe sull'importazione di principi attivi farmaceutici
- Requisiti rafforzati di tenuta dei registri per i distributori all'ingrosso
A partire dal 2019, tutti i prodotti farmaceutici devono soddisfare pienamente gli obblighi dell'afta epizootica. Fino al 2025, i paesi dell'UE con un sistema separato come la Grecia e l'Italia devono essere pienamente conformi al regolamento di tracciabilità farmaceutica.
Requisiti di serializzazione
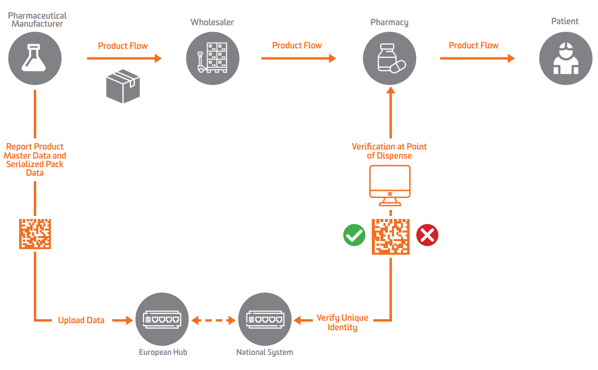
Secondo la FMD dell'UE, la serializzazione deve apparire a livello di unità secondaria o vendibile in Europa. Per abilitare la verifica, i produttori devono prima serializzare il prodotto e inviare i dati serializzati a un repository centrale che può eseguire query su di esso.
Per consentire la serializzazione, la verifica e la segnalazione alle autorità, la FMD UE richiede che i produttori contrassegnino le confezioni con quattro elementi di dati che devono essere stampati in formato leggibile dall'uomo e codificati e archiviati in un DataMatrix 2D GS1:
- Identificatore del prodotto
- Numero di serie
- Numero di lotto o lotto
- Data di scadenza
L’uso del quinto elemento di dati – il numero di rimborso nazionale – è facoltativo e pochi stati nell’UE possono richiedere di includere lo stesso in un identificatore univoco per collegare il rimborso di un prodotto farmaceutico nell’ambito di un programma di medicina socializzata.
I produttori farmaceutici e i commercianti paralleli devono comunicare i dati a un hub centrale dell'UE gestito dal Organizzazione europea per la verifica dei medicinali (EMVO), che integra anche gli utenti nell'Hub. Ciò spingerà i dati verso archivi di dati appropriati gestiti dalle corrispondenti organizzazioni nazionali di verifica dei medicinali (NMVO), che sono responsabili dell'onboarding degli utenti finali e del funzionamento dei sistemi nazionali.
Requisiti di segnalazione
Ai sensi della FMD europea, il titolare dell'autorizzazione all'immissione in commercio (MAH) è tenuto a inviare i dati anagrafici del prodotto e i dati della confezione del prodotto serializzati.
I dati anagrafici includono:
- Codici prodotto
- Modulo
- Forza
- Dosi per confezione
- Tipo di confezione
- Mercato/i di destinazione per la distribuzione
- Futuri ed eventuali aggiornamenti ai dati anagrafici del prodotto
I dati del pacchetto del prodotto serializzato includono:
- Codici prodotto
- Numero di lotto/lotto
- Data di scadenza
- Numeri seriali
- Eventuali aggiornamenti ai dati del pacchetto di prodotti serializzati
